Highlights
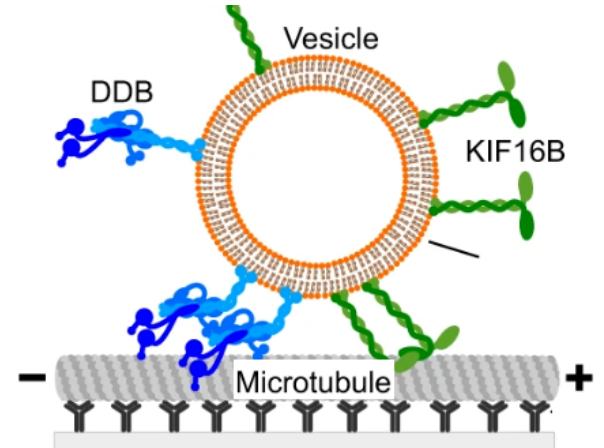
Vesikel, die von Dynein und Kinesin angetrieben werden, zeigen Richtungsumkehrungen ohne Regulatoren
Der intrazelluläre vesikuläre Transport entlang der Zytoskelettfilamente gewährleistet die gezielte Beförderung der Ladung. Dieser Transport ist selten unidirektional, sondern eher bidirektional, mit häufigen Richtungsumkehrungen aufgrund des gleichzeitigen Vorhandenseins von Motoren entgegengesetzter Polarität. Bisher war unklar, ob dieses komplexe Bewegungsmuster allein durch das mechanische Zusammenspiel der gegenpoligen Motoren zustande kommt oder ob dafür Regulatoren erforderlich sind.
In einer jüngst in Nature Communications erschienen Publikation zeigen wir - in Zusammenarbeit mit der Arbeitsgruppen von Stefan Diez (TU Dresden) - ein minimales System, bestehend aus gereinigtem Dynein-Dynactin-BICD2 (DBB) und Kinesin-3, (KIF 16B) das an große unilamellare Vesikel gebunden ist, die Frachtmotilität in vivo reproduziert, einschließlich Bewegung, Pausen und Umkehrungen. Es ist bemerkenswert, dass die Geschwindigkeit der Vesikel während der Bewegung nicht von den entgegengesetzten Motoren beeinflusst wird. Unser Berechnungsmodell zeigt, dass das Engagement einer kleinen Anzahl von Motoren für den Übergang zwischen Bewegung und Pausen entscheidend ist. Insgesamt deuten unsere Ergebnisse darauf hin, dass die Motoren, die an die vesikuläre Ladung gebunden sind, während der Pausen vorübergehend in ein Tauziehen verwickelt sind. In der Folge können stochastische An- und Abkopplungsereignisse von Motoren zu Richtungsänderungen führen, ohne dass dafür Regulatoren erforderlich sind.
Haftfähigkeit von Staphylococcus-aureus-Zellen ist ungleichmäßig über die Zellhülle verteilt
Staphylococcus aureus, ein gefürchteter Krankenhauskeim, kann schwerwiegende Infektionen verursachen. Eine bemerkenswerte Eigenschaft dieses Bakteriums ist seine außergewöhnliche Haftfähigkeit. Ein Team aus der Physik und der Medizin der Universität des Saarlandes konnte nun herausfinden, dass der Keim an manchen Stellen der Hülle besser haftet als an anderen. Ihre nun veröffentlichte Studie könnte Ausgangspunkt für wirkungsvollere bakterienabweisende Oberflächen sein.
Pressemitteilung der Universität des Saarlandes vom 17.10.2023
Originalpublikation:
C. Spengler, E. Maikranz, B. Glatz, M.A. Klatt, H. Heintz, M. Bischoff, L. Santen, A. Fery and K. Jacobs: “The adhesion capability of Staphylococcus aureus cells is heterogeneously distributed over the cell envelope”, Soft Matter, 2023 Advance Article.
