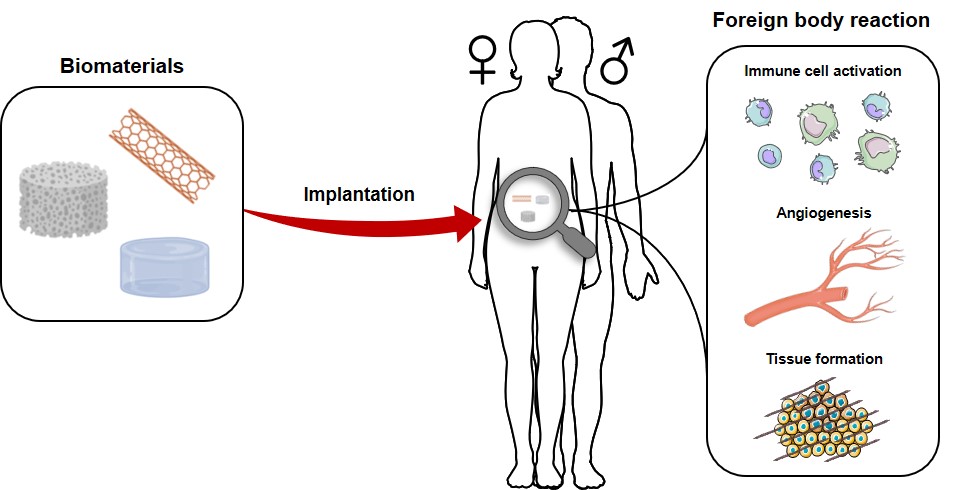
Geschlechtsspezifische Fremdkörperreaktionen auf implantierte Biomaterialien
Die Implantation von Biomaterialien in den menschlichen Körper ist ein integraler Bestandteil vieler moderner therapeutischer Ansätze im Bereich der regenerativen Medizin und des Tissue Engineering. Hierzu sollten die Biomaterialien eine gute Biokompatibilität aufweisen, um ihre langfristige Funktion und Sicherheit zu gewährleisten. Die Fremdkörperreaktion auf Biomaterialien ist ein dynamischer und komplexer Prozess, der von verschiedenen biologischen Mechanismen abhängig ist. Dazu gehören die Aktivierung und Rekrutierung von Immunzellen, die Angiogenese und die Bildung neuer extrazellulärer Matrixkomponenten an der Implantationsstelle.
Obwohl bekannt ist, dass das Geschlecht jeden dieser einzelnen Mechanismen beeinflusst, wurden geschlechtsspezifische Auswirkungen auf die Fremdkörperreaktion in der Biomaterialforschung bisher vernachlässigt. Um dies zu adressieren, werden wir die geschlechtsspezifische akute und chronische Fremdkörperreaktion auf verschiedene Arten von Biomaterialien in murinen in-vivo-Modellen mit Hilfe hochauflösender Bildgebungsverfahren untersuchen. Auf diese Weise soll gezeigt werden, welche Eigenschaften oder Modifikationen von Biomaterialien bei Frauen und Männern unterschiedliche Reaktionen hervorrufen, um so die Grundlage für personalisierte Biomaterialimplantate der Zukunft schaffen.

Projektleitung
Prof. Dr. med. Matthias W. Laschke, Ph.D.
Universität des Saarlandes
Institut für Klinisch-Experimentelle Chirurgie

PD Dr. rer. nat. Emmanuel Ampofo
Universität des Saarlandes
Institut für Klinisch-Experimentelle Chirurgie
Team
- Selina Wrublewsky
Universität des Saarlandes
Institut für Klinisch-Experimentelle Chirurgie - Caroline Bickelmann
Universität des Saarlandes
Institut für Klinisch-Experimentelle Chirurgie
Wichtige Publikationen
- Nalbach L, Müller D, Wrublewsky S, Metzger W, Menger MD, Laschke MW, Ampofo E. Microvascular fragment spheroids: Three-dimensional vascularization units for tissue engineering and regeneration. J Tissue Eng 12:20417314211035593, 2021
- Später T, Marschall JE, Brücker LK, Nickels RM, Metzger W, Mai AS, Menger MD, Laschke MW. Adipose tissue-derived microvascular fragments from male and female fat donors exhibit a comparable vascularization capacity. Front Bioeng Biotechnol 9:777687, 2021
- Nalbach L, Roma LP, Schmitt BM, Becker V, Körbel C, Wrublewsky S, Pack M, Später T, Metzger W, Menger MM, Frueh FS, Götz C, Lin H, Manning Fox JE, MacDonald PE, Menger MD, Laschke MW, Ampofo E. Improvement of islet transplantation by the fusion of islet cells with functional blood vessels. EMBO Mol Med 13:e12616, 2021
- Später T, Tobias AL, Menger MM, Nickels RM, Menger MD, Laschke MW. Biological coating with platelet-rich plasma and adipose tissue-derived microvascular fragments improves the vascularization, biocompatibility and tissue incorporation of porous polyethylene. Acta Biomater 108:194-206, 2020
- Schmitt BM, Boewe AS, Becker V, Nalbach L, Gu Y, Götz C, Menger MD, Laschke MW, Ampofo E. Protein kinase CK2 regulates nerve/glial antigen (NG)2-mediated angiogenic activity of human pericytes. Cells 9:1546, 2020
- Laschke MW, Augustin VA, Sahin F, Anschütz D, Metzger W, Scheuer C, Bischoff M, Aktas C, Menger MD. Surface modification by plasma etching impairs early vascularization and tissue incorporation of porous polyethylene (Medpor®) implants. J Biomed Mater Res B Appl Biomater 104:1738-1748, 2016
- Laschke MW, Vollmar B, Menger MD. The dorsal skinfold chamber: window into the dynamic interaction of biomaterials with their surrounding host tissue. Eur Cell Mater 22:147-164, 2011