Untersuchung geschlechtsspezifischer Unterschiede in der Funktion zytotoxischer Effektor-T-Lymphozyten bei Krebs, Autoimmunität und Entzündungen
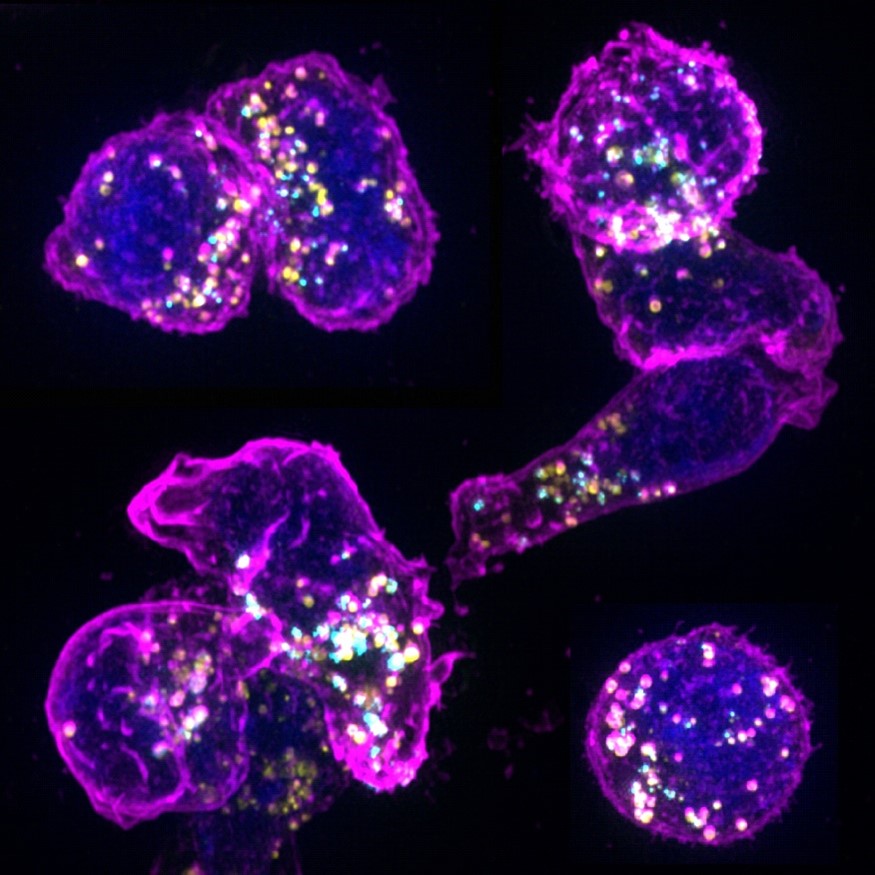
In diesem Forschungsprojekt soll untersucht werden, wie das Geschlecht die zytotoxischen T-Lymphozyten (CTLs) in kritischen Bereichen der menschlichen Gesundheit beeinflusst: Krebs, Autoimmunerkrankungen und Entzündungen. CTLs spielen eine entscheidende Rolle bei der adaptiven Immunität und zeigen bei Männern und Frauen unterschiedliche Reaktionen auf Infektionen, die sie anfällig oder resistent gegen Krankheiten einschließlich Krebs und Autoimmunerkrankungen machen. Frauen zeigen eine stärkere und schnellere Immunreaktion auf Infektionen als Männer, was auch ihre Anfälligkeit für Autoimmunkrankheiten erhöht. Die von uns neu identifizierten zytotoxischen Multicore-Granula (MCGs) bergen ein großes Potenzial zur Aufdeckung geschlechtsspezifischer Varianten in der Effektorfunktion von T-Zellen. MCGs enthalten lytische Komponenten, supramolekulare Angriffspartikel und Signalmoleküle wie Exosome und Zytokine. Sie dienen als neuartige multifunktionale Biowaffe, die von CTLs eingesetzt wird und auf spezifische pathologische Umgebungen zugeschnitten ist und die interzelluläre Kommunikation ermöglicht und Infektionen bekämpft. In Anbetracht des offensichtlichen Einflusses des Geschlechts auf die Immunantwort und die Krankheitsanfälligkeit zielt unsere Forschung darauf ab, die MCG-Produktion und -Verwendung in einer unterschiedlichen Population von CTLs zu untersuchen, die aus männlichen und weiblichen Mäusen und Menschen isoliert wurden. Diese Untersuchung soll wertvolle Erkenntnisse darüber liefern, wie T-Zellen ihre multifunktionale Biowaffe strategisch für die Tötung und die zelluläre Kommunikation in verschiedenen pathologischen Umgebungen wie Krebs, Autoimmunerkrankungen und Entzündungen einsetzen.

Projektleitung
Dr. Hsin-Fang Chang
Universität des Saarlandes
Centrum für Integrative Physiologie und Molekulare Medizin (CIPMM)
Zelluläre Neurophysiologie
Team
- Dr. Meltem Hohmann
- Dr. Claudia Schirra
- Marie-Louise Wirkner
- Szu-Min Tu
- Ching-Hsin Lin
Wichtige Publikationen
- Lin CH, Scheller A, Liu Y, Krause E, Chang HF (2023). Study of Effector CD8+ T Cell Interactions with Cortical Neurons in Response to Inflammation in Mouse Brain Slices and Neuronal Cultures. Int J Mol Sci. 24(4):3166.
- Fang LP, Zhao N, Caudal LC, Chang HF, Zhao R, Lin CH, Hainz N, Meier C, Bettler B, Huang W, Scheller A, Kirchhoff F, Bai X (2022). Impaired bidirectional communication between interneurons and oligodendrocyte precursor cells affects social cognitive behavior. Nat. Commun. 13(1):1394.
- Chang HF*, Schirra C, Ninov M, Hahn U, Ravichandran K, Krause E, Becherer U, Bálint Š, Harkiolaki M, Urlaub H, Valitutti S, Baldari CT, Dustin ML, Jahn R, and Rettig J* (2022). Identification of distinct cytotoxic granules as the origin of supramolecular attack particles in T lymphocytes. Nat. Commun. 13(1):1029. *corresponding author.
- Chang HF*, Wirkner ML, Krause E, Rettig J* (2020). Investigation of Cytotoxic T Lymphocyte Function during Allorejection in the Anterior Chamber of the Eye. Int. J. Mol. Sci. 21. 4660. *corresponding author.
- Lodygin D, Hermann M, Schweingruber N, Flügel-Koch C, Watanabe T, Schlosser C, Merlini A, Körner H, Chang HF, Fischer HJ, Reichardt HM, Zagrebelsky M, Mollenhauer B, Frahm J, Stadelmann C, Kügler S, Fitzner D, Haberl M, Odoardi F, Flügel A (2019). β-Synuclein reactive T cells induce autoimmune CNS grey matter degeneration. Nature 566, 503-508.
- Chang HF, Mannebach S, Beck A, Ravichandran K, Krause E, Frohnweiler K, Fecher-Trost C, Schirra C, Pattu V, Flockerzi V, Rettig J (2018). Cytotoxic granule exocytosis depends on the Flower protein. J. Cell Biol. 217, 667-683.
- Chang HF, Bzeih H, Schirra C, Chitirala P, Halimani M, Cordat E, Krause E, Rettig J, Pattu V (2016). Endocytosis of cytotoxic granules is essential for multiple killing of target cells by T lymphocytes. J. Immunol. 197, 2473-2484
- Matti U, Pattu V, Halimani M, Schirra C, Krause E, Liu Y, Weins L, Chang HF, Guzman R, Olausson J, Freichel M, Schmitz F, Pasche M, Becherer U, Bruns D, Rettig J (2013). Synaptobrevin2 is the v-SNARE required for cytotoxic T lymphocyte lytic granule fusion. Nat. Commun. 4, 1439