Dies verringert nicht nur die krankmachenden Eigenschaften des Erregers, sondern verstärkt gleichzeitig auch die Wirksamkeit von Antibiotika. Ihre Ergebnisse haben die Forscherinnen und Forscher in der Fachzeitschrift Advanced Science veröffentlicht.
Obwohl Bakterien zu den einfachsten Lebensformen auf unserem Planeten zählen, haben sie im Laufe der Evolution Wege entwickelt, um effizient miteinander zu kommunizieren. Im Gegensatz zum Menschen findet diese Kommunikation nicht mit Worten, sondern mit chemischen Signalen statt. Diese Interaktion spielt auch bei Infektionsprozessen pathogener Bakterien im Menschen eine fundamentale Rolle. So teilen Bakterien anderen Zellen in ihrem Schwarm zum Beispiel mit, wann es an der Zeit ist, Stoffe zu bilden, die dem menschlichen Immunsystem entgegenwirken. Die Beeinträchtigung dieser Kommunikationswege ist ein vielversprechender Ansatzpunkt für die Entwicklung neuer Wirkstoffe.
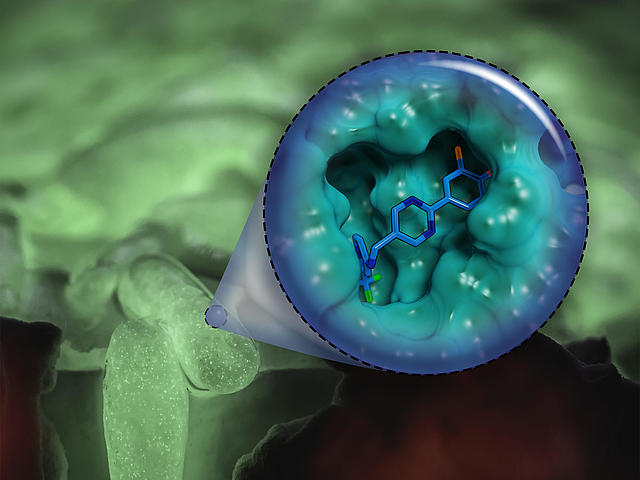
Im Fokus des Teams um Dr. Martin Empting, Leiter der Gruppe Antivirale und Antivirulenzwirkstoffe am HIPS, standen allerdings nicht die Kommunikationsbotenstoffe selbst, sondern deren Rezeptoren – also die Teile des Bakteriums, die für die Signalverarbeitung zuständig sind. Im konkreten Fall hatten die Forscherinnen und Forscher den Rezeptor PqsR im Visier. Wird dieser aktiviert, kommt es zur Bildung von entzündungsfördernden Substanzen sowie Biofilmen, in denen P. aeruginosa vor Antibiotika weitestgehend geschützt ist. Die nun beschriebene Wirkstoffklasse wurde von den Forschern chemisch so entworfen und optimiert, dass sie ihr Ziel PqsR möglichst effizient angreifen kann. Grundlage hierfür waren Strukturdaten, welche mittels Röntgenkristallographie ermittelt wurden.
„Da wir bei der Entwicklung neuer Wirkstoffe immer eine potenzielle Anwendung am Menschen als Ziel haben, mussten wir neben einer ausgezeichneten Wirksamkeit auch gute pharmakologische Eigenschaften erreichen und unerwünschte Nebenwirkungen minimieren“, sagt Martin Empting. Er erklärt weiter: „Das war nicht immer einfach, da selbst kleine Änderungen am Molekül oft große Auswirkung auf dessen Eigenschaften haben, aber wir können mit unserem Ergebnis sehr zufrieden sein.“ In weiteren Laborversuchen konnten die Wissenschaftler zeigen, dass die optimierte Substanz die Bildung des entzündungsfördernden Moleküls Pyocyanin bei einer Vielzahl klinischer Isolate von P. aeruginosa zuverlässig verhindert. Weiterhin konnten sie zeigen, dass der neue Wirkstoff dazu in der Lage ist, Biofilme aufzulösen und dabei sogar die Wirkung des Antibiotikums Tobramycin weiter verstärken kann. Die vielversprechenden Eigenschaften ihres Wirkstoffes konnten die Forscherinnen und Forscher abschließend auf ein Mausmodell übertragen. Hier konnte die gemeinsame Gabe von Tobramycin und dem neuen PqsR-Inhibitor die Infektion mit P. aeruginosa deutlich besser bekämpfen, als eine der beiden Substanzen alleine.
Die Autorinnen und Autoren sehen in der neuen Wirkstoffklasse ein großes Potenzial für eine zukünftige Anwendung am Menschen. Bevor die Substanz im Menschen getestet werden kann, müssen allerdings noch aufwendige präklinische Sicherheitsstudien und Entwicklungsprozesse durchlaufen werden. Martin Empting gibt dazu folgende Einschätzung: „Wir sehen das Potenzial, dass unsere Verbindungen bei Patienten mit chronischen Lungenerkrankungen wie Mukoviszidose oder Bronchiektase und damit verbundenen P. aeruginosa Infektionen in einigen Jahren therapeutisch zum Einsatz kommen könnten.“
Originalpublikation:
Hamed MH, Abdelsamie AS, Rox K, Schütz C, Kany AM, Röhrig T, Schmelz S, Blankenfeldt W, Arce-Rodriguez A, Borrero-de- Acuña JM, Jahn D, Rademacher J, Ringshausen FC, Cramer N, Tümmler B, Hirsch AKH, Hartmann RW & Empting M: Towards Translation of PqsR Inverse Agonists: From in vitro Efficacy Optimization to in vivo Proof-of-Principle. Advanced Science, 2023, DOI: 10.1002/advs.202204443
Weitere Infos und Kontakt unter: https://www.helmholtz-hips.de/